[메가경제=주영래 기자] 한미약품이 개발 중인 이중항체 기반 차세대 면역항암제가 글로벌 임상에서 초기 유효성과 안전성을 확보하며 상업화 가능성을 한층 끌어올리고 있다. 글로벌 면역항암제 시장에서 차세대 4-1BB 타깃 항암 후보물질이 임상 단계에서 안전성과 효능 신호를 동시에 확인한 것은 주목할 만한 성과로 평가된다.
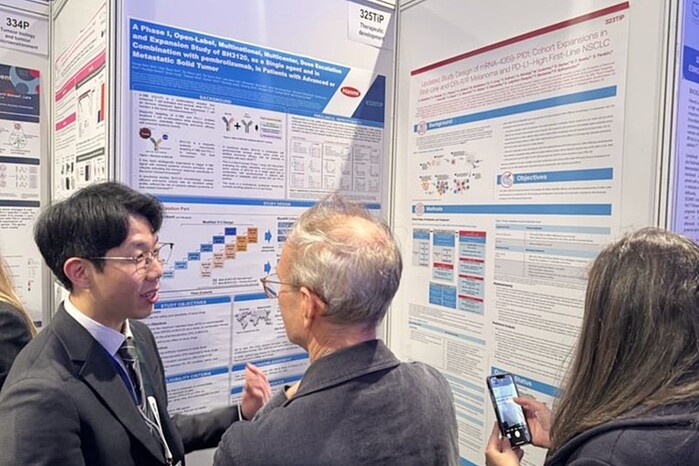
한미약품은 지난달 영국 런던에서 열린 ‘ESMO Immuno-Oncology Congress 2025(ESMO IO 2025)’에서 이중항체 면역항암제 ‘BH3120’의 글로벌 임상 1상 중간 결과를 공개했다고 13일 밝혔다. BH3120은 한국과 미국에서 진행성 또는 전이성 고형암 환자를 대상으로 단독 요법뿐 아니라 MSD의 항 PD-1 면역항암제 ‘키트루다(Keytruda)’와 병용 투여 연구를 병행 중이다.
 |
| ▲ 한미약품, 키트루다 병용 글로벌 임상 순항 |
이번 임상에서 용량 증량 파트는 계획대로 진행됐으며, 단독 및 병용 투여군에서 용량 제한 독성(DLT)은 확인되지 않았다. 표준치료제에 실패한 일부 환자군에서 초기 항종양 활성이 관찰된 만큼, 기존 면역항암제에 반응하지 않는 환자군에 대한 새로운 치료 옵션이 될 수 있다는 기대감도 커지고 있다.
BH3120은 한미약품의 독자적 이중항체 플랫폼 기술 ‘펜탐바디(Pentambody)’가 적용된 면역항암제로, 암세포 표면 PD-L1과 면역세포 표면 4-1BB를 동시에 타깃하도록 설계됐다. 이를 통해 항암 면역 활성화를 유도하면서도 정상조직에서의 독성을 억제해 기존 4-1BB 항체 후보물질이 가진 안전성 한계를 극복한 것이 특징이다.
한미약품은 앞서 미국암연구학회(AACR 2025)에서 전임상 데이터를 통해 종양미세환경(TME)과 정상조직 간 면역 활성의 디커플링(decoupling) 현상을 제시한 바 있다. 특히 간독성 평가 모델 및 스페로이드(spheoroid) 기반 유전자 분석 결과는 BH3120의 임상 개발 가능성을 뒷받침하는 자료로 평가되고 있다.
한미약품 ONCO임상팀 노영수 이사는 “펜탐바디 플랫폼을 활용한 첫 글로벌 임상이라는 점에서 의미가 크다”며 “기존 치료제의 한계를 보완하면서 안전성을 확보한 차세대 면역항암제 개발을 목표로 임상 완성도를 높여갈 것”이라고 말했다.
한미약품은 2024년 4월 MSD와 임상시험 협력 및 공급 계약을 체결하고 같은 해 9월 미국 FDA와 한국 식약처로부터 병용 임상시험계획(IND)을 승인받았다. 한미약품이 임상 스폰서를 맡고, MSD는 키트루다 공급을 담당한다.
글로벌 면역항암제 시장이 PD-1/PD-L1 계열 중심에서 새로운 면역 활성 기전으로 확장되는 가운데, 이중항체 기반 파이프라인은 업계 주요 차세대 후보로 부상하고 있다. 전문가들은 향후 임상 확장 시 상업적 가치가 높아질 가능성에도 주목하고 있다.
[ⓒ 메가경제. 무단전재-재배포 금지]