투여대상 나이 50대 초과로...투여시간 60분으로 단축
식약처가 ‘국내 1호’ 코로나19 치료제 ‘렉키로나주’의 품목허가를 조건부에서 정식으로 전환했다.
식품의약품안전처 “셀트리온사(社)가 8월 10일 제출한 국내 개발 코로나19 항체치료제 ‘렉키로나주(레그단비맙)’의 글로벌 3상 임상시험 결과 보고서를 면밀히 검토한 결과, 허가조건을 삭제하고 투약 가능한 환자의 범위를 확대하는 등의 내용으로 9월 17일 변경허가했다”고 17일 밝혔다. 조건부 품목허가가 정식 품목허가로 전환된 것이다.
앞서 식약처는 지난해 12월 19일 셀트리온이 허가 신청한 렉키로나주에 대해 올해 2월 5일 임상 2상 결과를 바탕으로 ‘3상 임상시험 결과 제출 조건’ 아래 품목허가를 내줬다.
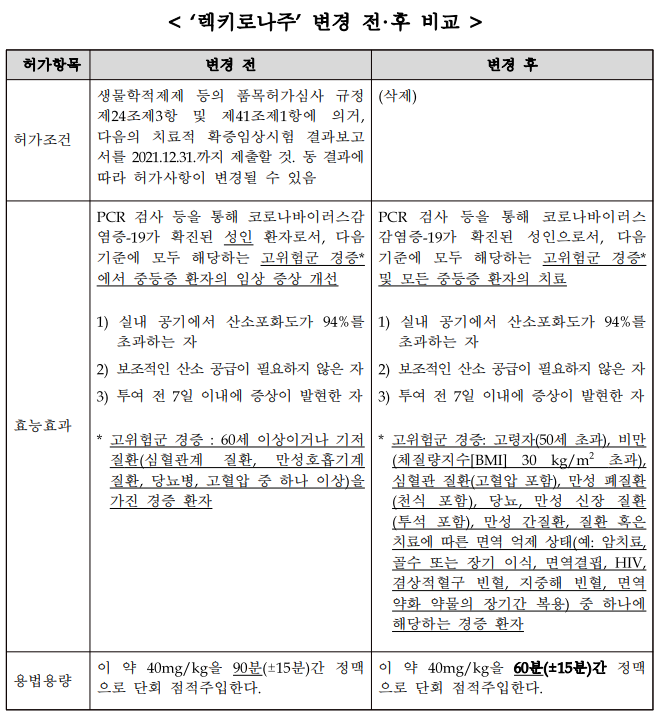 |
| ▲ '국내 1호’ 코로나19 항체치료제 ‘렉키로나주’ 변경 전후 비교. [식품의약품안전처 제공] |
렉키로나주는 코로나19 완치자의 혈액에 존재하는 중화항체 유전자를 선별하고 이 유전자를 대량 생산이 가능한 숙주 세포에 삽입(재조합)해 세포 배양을 통해 대량으로 생산하는 유전자재조합 중화항체치료제이다.
조건부 허가 당시 렉키로나주는 국내 개발 의약품으로는 최초로 코로나19 치료제로 허가받았으며, 코로나19 항체치료제로서 전 세계에서 세 번째로 규제당국의 검증을 받았다.
당시, 효능·효과는 ‘고위험군 경증에서 중등증 코로나19 성인(18세 이상) 환자의 임상 증상 개선’이라고 결정했으며, 투여 방법은 ‘90분 간 정맥 주사’하도록 했다.
식약처는 이번 정식 품목허가와 함께 렉키로나주의 효능·효과를 ‘코로나 19 고위험군 경증과 모든 중등증 성인 환자의 치료’로 변경했다.
조건부 허가 당시의 고위험군 경증 대상은 60세 이상이거나 기저질환(심혈관계 질환, 만성호흡기계 질환, 당뇨병, 고혈압 중 하나 이상)을 가진 경증 환자였다.
그러나 이번 변경으로 주사 대상의 나이가 50세 초과로 낮아지고 기저질환의 범위에 비만자(BMI 지수 30 초과), 만성 신장질환자(투석 포함), 만성간질환자, 면역 억제 환자(예: 암치료, 골수이식 등)가 추가됐다.
투여시간도 정식 품목허가와 함께 90분간 정맥투여에서 60분간으로 줄였다.
식약처는 렉키로나주의 안전성은 전반적으로 양호했다고 밝혔다.
3상 임상시험에서 렉키로나주의 이상사례 발생빈도는 위약군과 유사했고, 증상은 대부분 경증이나 중등증이었다.
가장 빈번하게 보고된 이상사례는 간효소 수치상승, 고중성지방혈증 등이 있었으며, 중대한 이상사례는 ‘주입관련반응’(환자 1명)으로 며칠 내에 회복됐다..
식약처는 “렉키로나주의 효과성은 코로나19로 인한 중증으로의 악화와 임상적 회복기간을 통계적으로 유의하게 감소시키는 것으로 확인됐다”고 밝혔다.
렉키로나주를 투여한 경증, 중등증 환자 중 고위험군 446명에서 중증으로 이환되는 비율이 위약(434명) 대비 72% 감소했고, 임상적 회복 기간도 위약(12.3일) 대비 4.12일 단축됐다.
식약처는 셀트리온이 변경 신청한 치료 대상 환자군에 대해 전문가와 중앙약사심의회 자문 등을 거친 결과, 종합적으로 사용 범위를 해당 임상시험에서 확인된 ‘고위험군 경증에서 모든 중등증 성인 환자’로 최종결정했다고 밝혔다.
다만, 셀트리온이 이번 변경허가에서 새롭게 치료 대상으로 신청한 ‘모든 경증’에 대해 검토한 결과, 고위험이 아닌 경증의 경우 중증 이환 빈도가 낮아 효과성에 대한 확증이 부족하다며 사용 범위에 포함하지 않았다.
또한 ‘12세 이상 소아’의 경우에도 임상시험 대상에 포함되지 않아 사용 범위에 포함하지 않는 것이 타당하다는 의견을 제시했다.
[메가경제=류수근 기자]
[ⓒ 메가경제. 무단전재-재배포 금지]