질병관리청은 2일 화이자 백신 11만7천 도즈(약 6만명 분)에 대해, 자문회의 결과를 반영해 식약처에 약사법 제85조의2에 따른 특례수입을 신청할 예정이라고 밝혔다.
자문회의에서 전문가들은 코백스 화이자 백신이 ▲ 세계보건기구(WHO)와 미 식품의약국(FDA) 등 주요국의 사용 승인을 받았고, 한국 식약처도 WHO 안전성·유효성 및 품질 평가에 협력 심사로 참여한 점 등을 고려해 특례 수입 필요성에 동의했다고 질병청은 전했다.
 |
| ▲ 화이자 코로나19 백신. [CG=연합뉴스TV 제공] |
코백스 퍼실리티는 코로나19 백신의 공동 개발 및 배분을 위한 국제적 프로젝트이다.
전문가 자문회의는 식약처와 질병청이 합동으로 개최했으며, 백신· 임상 전문가·의협 추천 전문가를 비롯해 모두 11인이 참석했다.
약사법 제85조의2 제1항은 감염병 대유행 등 국가비상 상황의 경우 관계부처의 장의 요청에 따라 국내 품목허가가 없는 예방·치료 의약품을 제조·수입할 수 있다.
특례수입은 감염병이 대유행하는 상황에 대처하기 위해 국내에 허가되지 않은 의약품을 외국에서 들여올 수 있게 하는 제도로, 코로나19 치료제인 '렘데시비르' 도입 과정에서도 활용됐다.
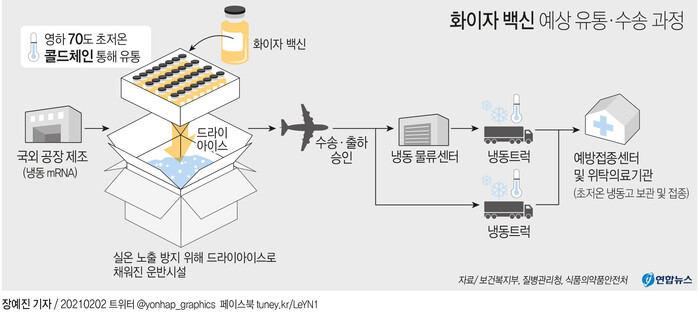 |
| ▲ 화이자 백신 예상 유통 및 수송 과정. [그래픽= 연합뉴스] |
현재 코백스 화이자 백신은 WHO의 긴급사용승인(EUL), 미국(FDA) 긴급사용승인(EUA), 유럽(EMA) 조건부 허가 등을 받은 상태다.
질병청은 이날 중 식약처에 코백스 화이자 백신에 대한 특례 수입을 신청한다.
질병청 관계자는 “식약처의 특례승인 절차가 마무리되는 대로 해당 백신이 국내에 도입될 수 있도록 화이자 사와 공급 관련 계약, 유엔아동기금(UNICEF)과 배송 계약, 통관 허가 등 관련 행정절차를 신속하게 진행할 예정”이라고 밝혔다.
또한 해당 백신이 국내에 도착하는 즉시 접종이 가능하도록 접종준비도 차질 없이 진행해 나가겠다고 덧붙였다.
[ⓒ 메가경제. 무단전재-재배포 금지]